


Рассмотрим ответы на Параграф 45 из учебника по химии для 9 класса Кузнецовой
Глава 10. Металлы главных и побочных подгрупп.
§45. Железо и его важнейшие соединения.
Вопрос в начале параграфа
Назовите области применения чистого железа.
Как происходит заполнение электронами электронных слоёв у атомов элементов побочных подгрупп?
Лабораторный опыт
1. Получите гидроксиды железа (II) и (III) из растворов соответствующих солей. Для этого к растворам солей Fe2+, Fe3+ прилейте раствор щёлочи. Сравните полученные осадки по внешнему виду.
2. Исследуйте свойства полученных соединений в соответствии со схемой, представленной на рисунке 80. Перед началом работы определите цель каждого опыта.
По всей видимости, за то время, которое вы затратили на выполнение опытов, цвет гидроксида железа (II) изменился: сначала он приобрел зеленоватый оттенок, затем зеленая окраска усилилась и постепенно перешла в бурую. Это объясняется тем, что гидроксид железа (17) на воздухе быстро окисляется в соответствии с уравнением реакции: 4Fe (OH)2 + 2H2O + O2 = 4Fe (OH)3
Вопросы в конце параграфа
1. Охарактеризуйте распространение железа в природе.
2. Дайте сравнительную характеристику свойств оксидов железа.
3. Составьте уравнения реакций в соответствии со следующей схемой превращений:
Fe2O3 ⟶ Fe ⟶ FeCl3 ⟶ Fe (OH)3 ⟶ Fe (NO3)3 ⟶ Fe
Fe3O4 ⟵ Fe ⟶ FeCl2 ⟶ Fe (OH)2
4. Расположите формулы оксидов в порядке усиления основных свойств.
1) FeO 2) CaO 3) Fe2O3 4) Na2O
5. Оксид железа (III) реагирует с
1) водой 2) азотной кислотой 3) хлоридом натрия 4) алюминием
6. Амфотерные свойства не проявляет
1) Fe (OH)3 2) Al (OH)3 3) Fe (OH)2 4) Zn (OH)2
7. Железный купорос, применяющийся в производстве чернил и красок, при окрашивании тканей, получают растворением обрезков стали в растворе серной кислоты. Составьте соответствующее уравнение реакции.
8. Подготовьте сообщение об истории открытия, свойствах и применении турнбулевой сини и берлинской лазури.
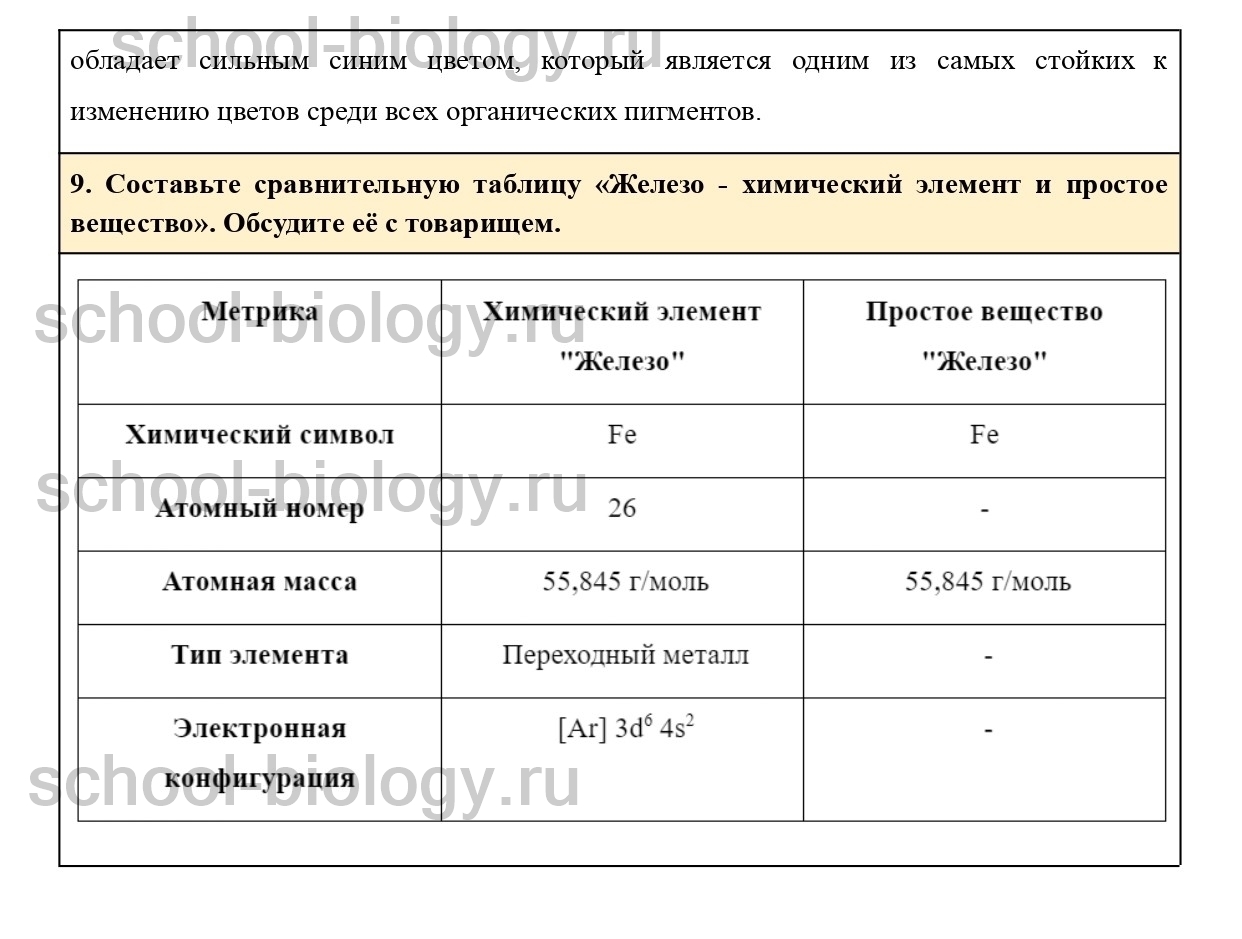
9. Составьте сравнительную таблицу «Железо — химический элемент и простое вещество». Обсудите её с товарищем.
Глава 10. Металлы главных и побочных подгрупп.
§45. Железо и его важнейшие соединения.
Вопрос в начале параграфа
Назовите области применения чистого железа.
Как происходит заполнение электронами электронных слоёв у атомов элементов побочных подгрупп?
Лабораторный опыт
1. Получите гидроксиды железа (II) и (III) из растворов соответствующих солей. Для этого к растворам солей Fe2+, Fe3+ прилейте раствор щёлочи. Сравните полученные осадки по внешнему виду.
2. Исследуйте свойства полученных соединений в соответствии со схемой, представленной на рисунке 80. Перед началом работы определите цель каждого опыта.
По всей видимости, за то время, которое вы затратили на выполнение опытов, цвет гидроксида железа (II) изменился: сначала он приобрел зеленоватый оттенок, затем зеленая окраска усилилась и постепенно перешла в бурую. Это объясняется тем, что гидроксид железа (17) на воздухе быстро окисляется в соответствии с уравнением реакции: 4Fe (OH)2 + 2H2O + O2 = 4Fe (OH)3
Вопросы в конце параграфа
1. Охарактеризуйте распространение железа в природе.
2. Дайте сравнительную характеристику свойств оксидов железа.
3. Составьте уравнения реакций в соответствии со следующей схемой превращений:
Fe2O3 ⟶ Fe ⟶ FeCl3 ⟶ Fe (OH)3 ⟶ Fe (NO3)3 ⟶ Fe
Fe3O4 ⟵ Fe ⟶ FeCl2 ⟶ Fe (OH)2
4. Расположите формулы оксидов в порядке усиления основных свойств.
1) FeO 2) CaO 3) Fe2O3 4) Na2O
5. Оксид железа (III) реагирует с
1) водой 2) азотной кислотой 3) хлоридом натрия 4) алюминием
6. Амфотерные свойства не проявляет
1) Fe (OH)3 2) Al (OH)3 3) Fe (OH)2 4) Zn (OH)2
7. Железный купорос, применяющийся в производстве чернил и красок, при окрашивании тканей, получают растворением обрезков стали в растворе серной кислоты. Составьте соответствующее уравнение реакции.
8. Подготовьте сообщение об истории открытия, свойствах и применении турнбулевой сини и берлинской лазури.
9. Составьте сравнительную таблицу «Железо — химический элемент и простое вещество». Обсудите её с товарищем.
